L’Ultrasonografia ad Alta Risoluzione nella Gestione Integrata del Linfedema e delle Patologie Vascolari Correlate
SUPERVISORE dr.ssa Marina CESTARI
1. Introduzione e Contesto Fisiopatologico
Il linfedema rappresenta una delle sfide cliniche più complesse e sottostimate nell’ambito della medicina vascolare e riabilitativa moderna. Definito come una condizione patologica cronica e progressiva, il linfedema è causato da un’insufficienza meccanica o dinamica del sistema linfatico, che conduce all’accumulo di fluido interstiziale ricco di proteine nello spazio extracellulare.1 Questa stasi, lungi dall’essere un mero problema idraulico, innesca una cascata infiammatoria cronica che trasforma radicalmente l’architettura dei tessuti molli, portando a fibrosi, deposizione adiposa patologica e alterazioni immunologiche locali.3
Storicamente, la diagnosi di linfedema è stata affidata quasi esclusivamente all’occhio e alla mano del clinico. Segni come l’edema non improntabile (nelle fasi avanzate), il segno di Stemmer positivo (l’impossibilità di plicare la cute alla base del secondo dito del piede) e l’asimmetria degli arti sono stati i pilastri della diagnostica per decenni.3 Tuttavia, la moderna linfologia richiede un cambio di paradigma verso una medicina di precisione. L’esame obiettivo, per quanto accurato, possiede limiti intrinseci nella rilevazione degli stadi subclinici (Stadio 0 ISL), nella caratterizzazione tissutale profonda e nella diagnosi differenziale con patologie mimetiche come il lipedema o il flebolinfedema.6
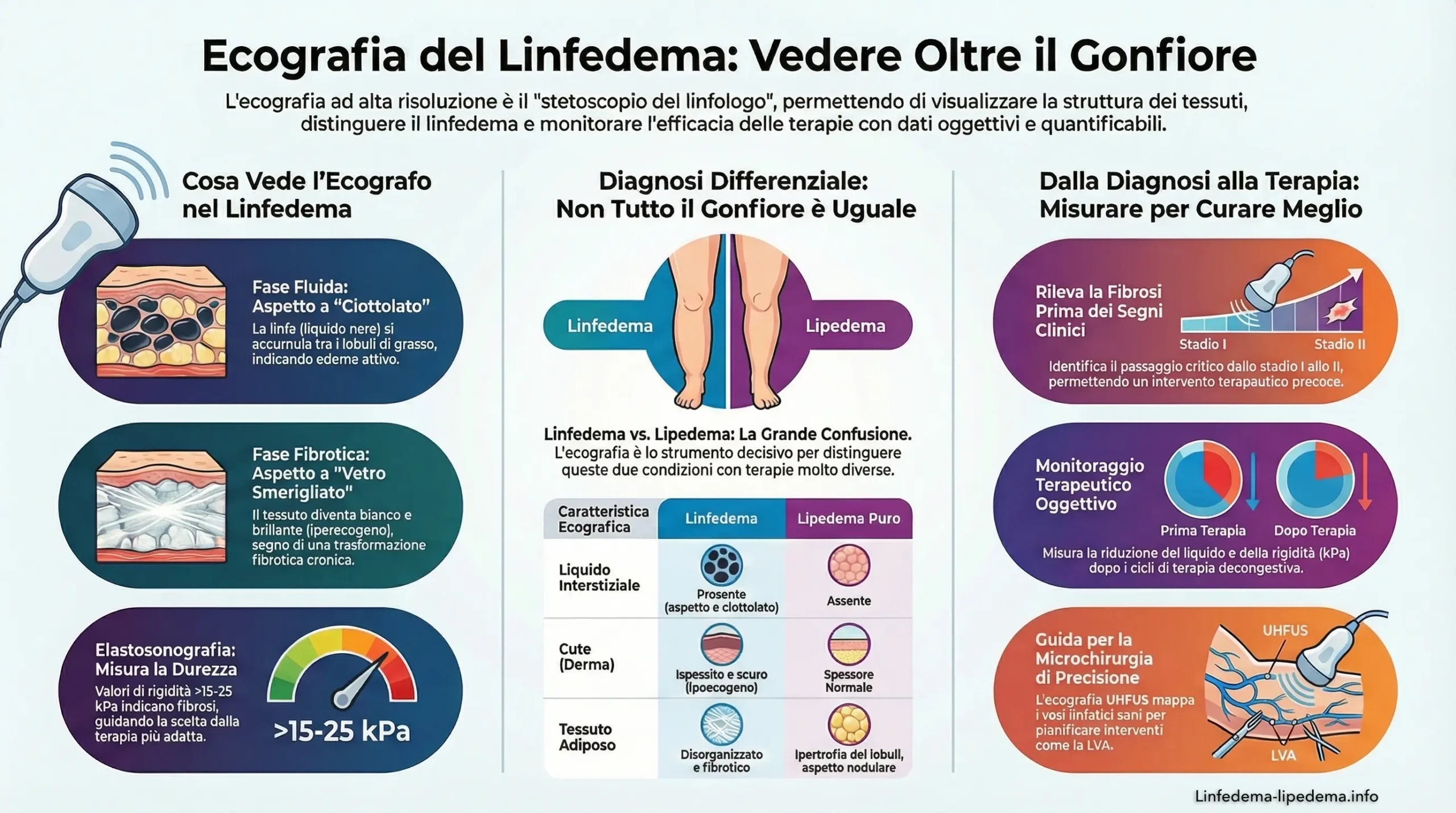
In questo scenario, l’ecografia ad alta risoluzione (High-Resolution Ultrasound – HRUS) e l’ecografia ad altissima frequenza (Ultra-High Frequency Ultrasound – UHFUS) emergono non più come strumenti ancillari, ma come “stetoscopio del linfologo”. La capacità degli ultrasuoni di penetrare i tessuti molli in modo non invasivo permette di visualizzare l’anatomia patologica in vivo, offrendo dati quantitativi su spessori cutanei, ecogenicità del sottocute e rigidità tissutale tramite elastosonografia.8 Questo report si prefigge di analizzare esaustivamente il ruolo della diagnostica ecografica, delineando protocolli specifici per la diagnosi precoce, la diagnosi differenziale e il monitoraggio terapeutico, con un linguaggio che, pur mantenendo il rigore scientifico necessario per il professionista, risulti accessibile al paziente informato che desidera comprendere il razionale del proprio percorso di cura.
1.1 Epidemiologia e Rilevanza Clinica
L’impatto epidemiologico del linfedema è vasto. Si stima che circa 300 milioni di persone nel mondo ne siano affette, con la filariosi come causa primaria globale e le forme secondarie (post-oncologiche, post-chirurgiche, post-traumatiche) prevalenti nei paesi industrializzati.11 In particolare, il linfedema correlato al cancro al seno (BCRL) rimane una complicanza temuta, la cui diagnosi precoce tramite tecniche di imaging può prevenire la progressione verso stadi fibrotici irreversibili.11 Inoltre, l’aumento dell’incidenza dell’insufficienza venosa cronica (CVI) e dell’obesità ha portato a un incremento esponenziale dei casi di flebolinfedema, una condizione mista che richiede una diagnosi ecografica precisa per distinguere le componenti venose da quelle linfatiche.13
2. Fisica degli Ultrasuoni Applicata alla Linfologia
Per comprendere appieno le potenzialità diagnostiche, è fondamentale analizzare i principi fisici che governano l’interazione tra onde sonore e tessuti linfedematosi.
2.1 B-Mode e Frequenze: La Risoluzione Necessaria
L’ecografia B-Mode (Brightness Mode) trasforma l’ampiezza dell’onda sonora di ritorno in un punto di luminosità variabile sullo schermo.15 Nel contesto linfologico, la scelta della frequenza della sonda è critica.
Le sonde convenzionali (3-5 MHz) utilizzate per l’addome non offrono una risoluzione sufficiente per studiare la cute e il sottocute superficiale. La diagnostica del linfedema richiede trasduttori lineari ad alta frequenza, tipicamente nel range di 10-22 MHz.9
- Alta Frequenza (15-22 MHz): Permette una risoluzione assiale inferiore a 0.1 mm, ideale per distinguere l’epidermide dal derma e visualizzare i lobuli adiposi nel sottocute superficiale. Tuttavia, la penetrazione è limitata a 3-4 cm, rendendo queste sonde perfette per l’analisi dell’edema epifasciale.9
- Altissima Frequenza (UHFUS 30-70 MHz): Questa tecnologia di frontiera permette di visualizzare strutture microscopiche come i vasi linfatici collettori (spesso di diametro 0.3-0.8 mm) e le venule superficiali. È lo strumento d’elezione per la pianificazione preoperatoria della microchirurgia linfatica (LVA).18
2.2 Elastosonografia: Misurare la Rigidità
Mentre il B-Mode valuta l’anatomia, l’elastosonografia valuta le proprietà meccaniche dei tessuti, specificamente la loro rigidità (stiffness). Nel linfedema, dove la fibrosi è il principale fattore di cronicità, questo parametro è cruciale.
Esistono due macro-categorie:
- Strain Elastography (SE): Qualitativa o semi-quantitativa. Misura la deformazione del tessuto sotto una compressione manuale o fisiologica. È utile per un colpo d’occhio rapido ma dipende dall’operatore.20
- Shear Wave Elastography (SWE): Quantitativa. Utilizza impulsi di forza di radiazione acustica (ARFI) per generare onde di taglio (shear waves) trasversali. La velocità di propagazione di queste onde ($V_s$) è direttamente proporzionale alla rigidità del tessuto. Il risultato è espresso in metri al secondo (m/s) o convertito in kiloPascal (kPa) tramite il modulo di Young ($E \approx 3\rho V_s^2$).21
Questa tecnica fornisce un dato numerico oggettivo, fondamentale per monitorare l’evoluzione della fibrosi nel tempo e la risposta alle terapie.22
3. Anatomia Ecografica Comparata: Sano vs Patologico
L’esame ecografico del linfedema si basa sul riconoscimento di pattern specifici e sull’alterazione della normale architettura tissutale. Un’analisi comparativa con l’arto sano controlaterale (o con zone sane nello stesso arto) è mandatoria.
3.1 La Cute (Complesso Epidermide-Derma)
Nel soggetto sano, la cute appare all’ecografia ad alta frequenza come una struttura bilaminare:
- Epidermide: Una linea iperecogena (bianca brillante) molto sottile superficiale.
- Derma: Una banda iperecogena sottostante, omogenea e compatta.9
Nel Linfedema:
Si osserva un ispessimento dermico diffuso. L’accumulo di fluido all’interno del derma riduce la sua ecogenicità (diventa più scuro o ipoecogeno) a causa della dispersione delle fibre collagene da parte dell’acqua. Questo fenomeno è noto come “edema cutaneo” o dermal backflow visibile ecograficamente.12 Nelle fasi avanzate (Stadio III), l’ipercheratosi e la papillomatosi possono rendere la superficie cutanea irregolare, con un aspetto “a montagne russe”.17
3.2 Il Tessuto Sottocutaneo (Ipoderma)
È qui che avvengono i cambiamenti più drammatici. Normalmente, il sottocute è prevalentemente ipoecogeno (grasso scuro) con sottili setti fibrosi iperecogeni.
Fase Fluida (Linfedema Precoce/Attivo):
Il segno ecografico cardine è l’aspetto “a ciottolato” (Cobblestone Appearance).8
- Descrizione: L’edema fluido (linfa) si accumula nei setti interlobulari, dilatandoli. Poiché il fluido è anecogeno (nero) e il grasso è relativamente ipoecogeno/grigio, si crea un pattern reticolare in cui i lobuli di grasso (“ciottoli”) sono circondati da canali di fluido.
- Significato Clinico: Questo pattern indica un edema interstiziale mobile, ricco di acqua libera. È tipico dello Stadio I o delle fasi di riacutizzazione (es. cellulite). È importante notare che questo segno non è specifico del solo linfedema, ma si trova anche nello scompenso cardiaco e nella cellulite infettiva; tuttavia, nel linfedema tende a essere confinato al comparto soprafasciale senza coinvolgere il muscolo.8
Fase Fibrotica (Linfedema Tardivo):
Con la cronicizzazione, il fluido ricco di proteine stimola la fibrogenesi e l’adipogenesi.4
- Descrizione: Il netto contrasto del “ciottolato” scompare. Il sottocute diventa diffusamente iperecogeno (bianco e brillante) e perde la distinzione tra lobuli e setti. L’aspetto diventa “vetroso” o “nebbioso” (ground glass).
- Cancellazione delle Fasce: La fibrosi progressiva rende difficile distinguere la fascia muscolare profonda e la giunzione dermo-ipodermica, che appaiono sfumate o assenti.17 Questo segno di “confini sfocati” è un indicatore prognostico negativo, suggerendo una trasformazione tissutale irreversibile.
3.3 La Fascia e il Comparto Sottostante
Un elemento diagnostico differenziale chiave fornito dall’ecografia è la valutazione del comparto sotto-fasciale (muscolare).
- Nel Linfedema: L’edema è strettamente epifasciale (sopra la fascia). Il comparto muscolare appare ecograficamente normale, senza accumulo di fluido tra le fibre muscolari, a meno che non vi sia una sindrome compartimentale o un trauma associato.8
- Nell’Edema Sistemico (es. renale, cardiaco): Il fluido può trovarsi anche nel comparto profondo.
4. Diagnosi Differenziale Ecografica: Oltre l’Edema Generico
La “gamba gonfia” è un sintomo aspecifico. L’ecografia è lo strumento dirimente per distinguere il linfedema vero dalle sue numerose mimetiche. Questa distinzione è cruciale poiché le terapie sono radicalmente diverse (es. la compressione è fondamentale nel linfedema ma può essere meno tollerata o inefficace in altre condizioni senza una diagnosi precisa).
4.1 Linfedema vs Lipedema: La Grande Confusione
Il lipedema è una patologia del tessuto adiposo, spesso confusa con il linfedema o l’obesità. Colpisce quasi esclusivamente le donne ed è caratterizzato da accumulo sproporzionato di grasso agli arti inferiori, dolore e facilità ai lividi.7
Tabella 1: Diagnosi Differenziale Ecografica Linfedema vs Lipedema
| Caratteristica | Linfedema (o Flebolinfedema) | Lipedema Puro (Stadi I-II) |
| Clinica | Asimmetrico, Segno di Stemmer positivo, coinvolge piedi/mani (dorso) | Simmetrico, Segno di Stemmer negativo, risparmia i piedi (“segno del calzino”), dolore 7 |
| Fluido Interstiziale | Presente. Aspetto a “ciottolato” o laghi anecogeni. | Assente. Nessun fluido libero tra i lobuli.28 |
| Complesso Epidermide-Derma | Ispessito e Ipoecogeno. Edema dermico presente. | Normale. Spessore ed ecogenicità dermica conservati.28 |
| Tessuto Adiposo (Sottocute) | Disorganizzato, fibrotico (iperecogeno), confini fasciali sfumati. | Ipertrofia dei lobuli adiposi, aspetto nodulare (“sinciziale”), setti sottili o ispessiti ma definiti.28 |
| Risposta alla Compressione | Riduzione volumetrica significativa (spostamento fluido). | Riduzione scarsa (il grasso non si sposta con la pressione). |
Nota Bene: Esiste il “Lipo-Linfedema” (Stadio IV del Lipedema), in cui il peso del grasso collassa i vasi linfatici causando un linfedema secondario. In questo caso, l’ecografia mostrerà un quadro misto: l’ipertrofia adiposa tipica del lipedema più il segno del ciottolato e i laghi fluidi tipici del linfedema.14
4.2 Flebolinfedema (Combined Venous-Lymphatic Insufficiency)
Questa è la forma più comune in Occidente. L’insufficienza venosa cronica (CVI) aumenta la pressione di filtrazione capillare; quando il sistema linfatico non riesce più a compensare questo sovraccarico (“high output failure”), si sviluppa il flebolinfedema.11
Segni Ecografici Specifici:
- Segni Venosi: L’Eco-Color Doppler evidenzia reflusso nelle vene safene o nel sistema profondo, varici, o segni di pregressa trombosi (pareti venose ispessite, sinechie).31
- Lipodermatosclerosi: La fibrosi sottocutanea nel flebolinfedema è spesso caratterizzata da calcificazioni puntiformi o placche iperecogene molto dense nel terzo distale di gamba, associate a depositi di emosiderina (visibili clinicamente come macchie brune, ecograficamente come aree di disorganizzazione strutturale superficiale).4
- Vasi Collaterali: Spesso si visualizzano vene superficiali tortuose immerse nell’edema sottocutaneo.31
4.3 Cellulite Infettiva vs Pseudo-Cellulite (Dermatite da Stasi)
I pazienti con linfedema sono proni a infezioni (erisipela/cellulite). L’ecografia è vitale per distinguere un’infezione attiva (che richiede antibiotici) da una dermatite infiammatoria sterile (che richiede steroidi/compressione).
- Cellulite Infettiva: Il tessuto sottocutaneo mostra un “ciottolato” estremo con fluido torbido. Il Color Doppler rivela una iperemia diffusa (aumento del flusso sanguigno nei tessuti molli) a “tempesta di fuoco”. Possono essere presenti ascessi focali (raccolte fluide con enhancement posteriore).8
- Pseudo-Cellulite: Sebbene la gamba sia rossa, l’ecografia mostra edema ma assenza di iperemia significativa o raccolte ascessuali.
4.4 Cisti di Baker e Masse Compressive
Un gonfiore improvviso del polpaccio può essere causato dalla rottura di una cisti di Baker (cisti poplitea). L’ecografia visualizza facilmente la cisti come una struttura anecogena a “becco di flauto” che si estende dal cavo popliteo verso il basso tra i muscoli gastrocnemi, permettendo di escludere un linfedema acuto o una TVP.8 Allo stesso modo, l’ecografia può identificare masse (tumori, ematomi) che comprimono le vie linfatiche prossimali (es. nel cavo ascellare o inguinale) causando linfedema secondario.33
5. Stadiazione Ecografica Avanzata e Correlazione ISL
La classificazione clinica dell’International Society of Lymphology (ISL) divide il linfedema in stadi da 0 a III. L’ecografia permette una sotto-stadiazione più raffinata, fondamentale per la prognosi.
Tabella 2: Correlazione tra Stadio Clinico ISL e Reperti Ecografici
| Stadio ISL | Descrizione Clinica | Reperti Ecografici (B-Mode & Elastosonografia) |
| Stadio 0 (Latente) | Nessun edema visibile. Sensazione di pesantezza. Sistema linfatico compromesso. | B-Mode: Spessore cutaneo/sottocutaneo normale o asimmetria minima (<10%). Possibile visualizzazione di vasi linfatici lievemente ectasici all’UHFUS. Elastosonografia: Valori di stiffness normali. |
| Stadio I (Reversibile) | Edema morbido che regredisce con l’elevazione. Fovea positiva. | B-Mode: Tipico aspetto a “ciottolato” (edema fluido ipoecogeno). Spessore sottocutaneo aumentato ma comprimibile con la sonda. Fasce ben visibili. Elastosonografia: Stiffness bassa (il fluido è morbido). |
| Stadio IIa (Spontaneamente Irreversibile) | Edema persistente. Inizia la fibrosi. Fovea difficile. | B-Mode: Coesistenza di aree fluide (ciottolato) e aree iperecogene (fibrosi iniziale). Ispessimento dermico marcato. Elastosonografia: Aumento focale della stiffness nelle aree fibrotiche. |
| Stadio IIb (Tardivo) | Edema duro. Fovea assente. | B-Mode: Prevalenza di iperecogenicità diffusa (“nebbia”). Scomparsa dell’aspetto a ciottolato sostituito da tessuto solido. Fascia muscolare poco definita. Elastosonografia: Valori di stiffness elevati (>15-20 kPa). |
| Stadio III (Elefantiasi) | Edema massivo, alterazioni cutanee (acantosi, papillomi). | B-Mode: Sottocute iper-ecogeno e omogeneo. Ispessimento epidermico e dermico estremo. Calcificazioni. Laghi linfatici isolati. Elastosonografia:Tessuto estremamente rigido (“legnoso”). |
5.1 Importanza dello Stadio II Precoce
Il passaggio dallo Stadio I allo Stadio II è critico. L’ecografia può rilevare l’inizio della deposizione fibrotica (aumento dell’ecogenicità) prima che la fovea clinica scompaia.17 Questo è il momento d’oro per intensificare la terapia compressiva ed evitare danni permanenti.
6. Tecnologie Avanzate: Elastosonografia e UHFUS
6.1 Elastosonografia Shear Wave (SWE)
L’elastosonografia trasforma la sensazione palpatoria di “tessuto duro” in un numero. Utilizzando la tecnologia Shear Wave, possiamo misurare il Modulo di Young in kPa.10
- Valori di Riferimento:
- Tessuto sottocutaneo sano: < 5-10 kPa.
- Linfedema Fibrotico: Valori spesso > 15-25 kPa, con picchi oltre i 40-50 kPa in aree di forte sclerosi.22
- Utilità nel Monitoraggio: Una riduzione dei valori kPa dopo un ciclo di fisioterapia indica un ammorbidimento dei tessuti (tissue softening), un endpoint terapeutico fondamentale anche se il volume dell’arto non cambia drasticamente.37
- Utilità nei Linfonodi: Nella diagnosi oncologica, i linfonodi metastatici tendono ad essere molto più rigidi (es. >42 kPa) rispetto ai linfonodi reattivi o sani (ca. 10-20 kPa).20
6.2 Ecografia ad Altissima Frequenza (UHFUS) e Microchirurgia
L’UHFUS (48-70 MHz) ha aperto la strada alla “Micro-Linfologia”.18
- Visualizzazione dei Collettori: È possibile vedere vasi linfatici di 0.3-0.5 mm. Nel linfedema, questi vasi possono apparire dilatati (ectasici) o sclerotici (pareti ispessite, lume collassato).
- Pianificazione LVA (Lymphaticovenous Anastomosis): Il chirurgo usa l’UHFUS per mappare pre-operatoriamente dove un vaso linfatico funzionante incrocia una venula di calibro compatibile. Questo permette di eseguire incisioni cutanee di soli 2-3 cm esattamente sopra il sito di anastomosi, riducendo tempi e invasività rispetto alla ricerca “alla cieca” o guidata solo dal verde indocianina.18
7. Protocollo di Monitoraggio Ecografico delle Terapie
L’ecografia non serve solo alla diagnosi, ma è il miglior strumento per validare l’efficacia della Terapia Decongestiva Complessa (CDT), che include linfodrenaggio manuale, bendaggio multistrato, cura della pelle ed esercizi.5
7.1 Protocollo di Misurazione Standardizzato
Per monitorare l’evoluzione, le misurazioni devono essere riproducibili 38:
- Punti di Repere Fissi:
- Arto Superiore: 10 cm sopra e 10 cm sotto l’epicondilo laterale (gomito).
- Arto Inferiore: 10 cm sopra il bordo superiore della rotula e 10 cm sotto la tuberosità tibiale.
- Parametri da Registrare:
- Spessore totale sottocutaneo (mm).
- Spessore del derma (mm).
- Ecogenicità (Scala qualitativa: anecogena, ipoecogena, iperecogena).
- Presenza di fluidi liberi (Sì/No).
- Stiffness media (kPa) in 3 ROI (Region of Interest) per punto.
7.2 Interpretazione dei Cambiamenti Post-Terapia
- Fase di Attacco (Riduzione): Dopo 2-4 settimane di bendaggio intensivo, l’ecografia mostra tipicamente una riduzione dello spessore totale a spese della componente fluida (scomparsa del “ciottolato” e delle lacune anecogene). Lo spessore del tessuto solido (fibrotico) cambia poco in questa fase.37
- Fase di Mantenimento: L’uso costante di indumenti elastocompressivi a trama piatta mira a prevenire il ritorno del fluido. Un aumento dello spessore o la ricomparsa di lacune fluide all’ecografia di controllo è un segno precoce di “fallimento della contenzione” (indumento usurato o classe di compressione insufficiente), che richiede un intervento correttivo immediato.5
- Monitoraggio Chirurgico: Nel post-operatorio di LVA o trapianto linfonodale, l’ecografia valuta la riduzione dello spessore dermico e la diminuzione della stiffness come marker di ripristino del flusso linfatico fisiologico.
8. Conclusioni e Prospettive Future
L’ecografia nel linfedema ha compiuto un salto qualitativo da tecnica di esclusione a pilastro della gestione clinica. Non si tratta più solo di dire “non è una trombosi”, ma di definire “che tipo di edema è, quanto è fibrotico, e dove sono i vasi sani per operare”.
Messaggi Chiave per il Paziente:
- Precisione Diagnostica: Se avete una “gamba gonfia”, l’ecografia (eseguita da un esperto linfologo) può dirvi se è linfa, grasso (lipedema), sangue (venoso) o un mix, evitando anni di terapie sbagliate.
- Prevenzione: L’ecografia può vedere il linfedema “nascosto” (Stadio 0-1) prima che la gamba si gonfi visibilmente, permettendo cure preventive.
- Personalizzazione: La terapia non è uguale per tutti. Se l’ecografia vede “acqua”, serve drenaggio e bendaggio; se vede “fibrosi dura”, servono compressioni forti e specifici esercizi; se vede “grasso puro”, potrebbe servire la chirurgia riduttiva.
- Monitoraggio: Chiedete che i vostri progressi siano misurati non solo con il metro da sarta, ma con l’ecografia, per essere certi che la cura stia funzionando nel profondo dei tessuti.
L’integrazione sistematica dell’ecografia ad alta risoluzione, dell’elastosonografia e dell’UHFUS rappresenta oggi il gold standard funzionale per una moderna linfologia, trasformando una patologia storicamente “orfana” in una condizione gestibile con precisione scientifica.
Nota Metodologica
Questo report è stato redatto sintetizzando le evidenze scientifiche più recenti nel campo della linfologia e dell’ultrasonografia clinica. I dati sono stati estratti e integrati da una revisione sistematica della letteratura specializzata 1, con particolare attenzione alle linee guida dell’International Society of Lymphology e agli studi pionieristici sulla microchirurgia linfatica e l’elastosonografia tissutale.
Bibliografia
- Linfedema – Diagnosi e Trattamenti a Milano – Istituto IDE, https://www.ide.it/patologie/linfedema-arti-inferiori/
- Linfedema: eziologia, sintomi e trattamento – Santagostino Magazine, https://www.santagostino.it/magazine/linfedema/
- Linfedema: sintomi, cause e trattamento – Nurse24.it, https://www.nurse24.it/studenti/patologia/linfedema-ristagno-linfa.html
- Persistent edema leading to subcutaneous scarring in healed diabetic foot ulcer: a case study of ultrasonographic findings – Cambridge Media Journals, https://journals.cambridgemedia.com.au/wpr/volume-33-number-1/persistent-edema-leading-subcutaneous-scarring-healed-diabetic-foot-ulcer-case-study-ultrasonographic-findings
- Dalla Clinica alla Terapia – Nicola Chiulli ecografia flebologia, https://www.nicolachiulliecografiaflebologia.it/wp-content/uploads/2016/03/Relazione-Gamba-gonfia-2016.pdf
- Linfologo – Humanitas Medical Care, https://www.humanitas-care.it/enciclopedia/specialisti/linfologo/
- Lipedema vs Linfedema: le differenze – CDI Centro Diagnostico Italiano, https://www.cdi.it/news/lipedema-vs-linfedema-le-differenze/
- Cellulitis – Internet Book Of MSK Ultrasound, https://mskultrasound.net/cellulitis/
- High-Frequency and Ultra-High-Frequency Ultrasound in Dermatologic Diseases and Aesthetic Medicine – MDPI, https://www.mdpi.com/1648-9144/61/2/220
- Shear Wave Elastography for Distinguishing Cervical Lymph Node Malignancy: A Prospective, Observational Study – PMC – PubMed Central, https://pmc.ncbi.nlm.nih.gov/articles/PMC12383889/
- Phlebolymphedema–A Common Underdiagnosed and Undertreated Problem in the Wound Care Clinic – PMC – NIH, https://pmc.ncbi.nlm.nih.gov/articles/PMC3601853/
- High-Frequency Ultrasonography Imaging: Anatomical Measuring Site as Potential Clinical Marker for Early Identification of Breast Cancer-Related Lymphedema – PMC, https://pmc.ncbi.nlm.nih.gov/articles/PMC12191270/
- Lymphedema and Phlebolymphedema | WoundSource, https://www.woundsource.com/patientcondition/lymphedemaphlebolymphedema
- Lipedema, Lymphedema, & Phlebolymphedema: What’s the difference & can they be treated? – Get Healthy Veins, https://www.gethealthyveins.com/2021/08/18/lipedema-lymphedema-phlebolymphedema-whats-the-difference-can-they-be-treated/
- Grey scale imaging (ultrasound) | Radiology Reference Article | Radiopaedia.org,https://radiopaedia.org/articles/grey-scale-imaging-ultrasound
- The A, B, Ms – Ultrasound Modes Explained – IMV imaging, https://www.imv-imaging.com/en/2023/04/news-the-a-b-ms-ultrasound-modes-explained/
- Significance of Ultrasound Examination of Skin and Subcutaneous Tissue in Secondary Lower Extremity Lymphedema – PMC – NIH, https://pmc.ncbi.nlm.nih.gov/articles/PMC3692988/
- New ultra-high-frequency ultrasound improves lymphedema treatment – Ohio State Health & Discovery, https://health.osu.edu/discovery-and-innovation/treatment-advances/ultra-high-frequency-ultrasound-improves-lymphedema-treatment
- Imaging Modalities for Evaluating Lymphedema – PMC – PubMed Central, https://pmc.ncbi.nlm.nih.gov/articles/PMC10673374/
- Differential Diagnosis Value of Shear-Wave Elastography for Superficial Enlarged Lymph Nodes – PMC – PubMed Central, https://pmc.ncbi.nlm.nih.gov/articles/PMC9280688/
- Ultrasound Elastography for the Evaluation of Lymph Nodes – PMC – PubMed Central, https://pmc.ncbi.nlm.nih.gov/articles/PMC8415874/
- (PDF) Shear Wave Elastography to Quantitatively Assess the Early Changes of Skin Elasticity in Patients with Chronic Venous Disease of the Lower Extremity – ResearchGate, https://www.researchgate.net/publication/396332572_Shear_Wave_Elastography_to_Quantitatively_Assess_the_Early_Changes_of_Skin_Elasticity_in_Patients_with_Chronic_Venous_Disease_of_the_Lower_Extremity
- Shear wave elastography to quantitatively assess the early changes of | IJGM, https://www.dovepress.com/shear-wave-elastography-to-quantitatively-assess-the-early-changes-of–peer-reviewed-fulltext-article-IJGM
- Cobblestone-like Skin – PMC – NIH, https://pmc.ncbi.nlm.nih.gov/articles/PMC9681216/
- Ultrasound for the Evaluation of Skin and Soft Tissue Infections – PMC, https://pmc.ncbi.nlm.nih.gov/articles/PMC6170135/
- Persistent edema leading to subcutaneous scarring in healed diabetic foot ulcer: a case study of ultrasonographic findings – Cambridge Media Journals, https://journals.cambridgemedia.com.au/download_file/9705/1184
- Differential diagnoses and treatment of lipedema – OAE Publishing Inc., https://www.oaepublish.com/articles/2347-9264.2019.51
- Ecografia nei pazienti con lipedema. Autori … – LIO Lipedema Italia, https://lipedemaitalia.info/wp-content/uploads/2024/06/cap-4-qr-code-6-ecografia-mander-cestari-bruno.pdf
- High-resolution cutaneous ultrasonography to differentiate lipoedema from lymphoedema – PubMed, https://pubmed.ncbi.nlm.nih.gov/20408836/
- Understanding Lower Extremity Phlebolymphedema Fibrosis, https://lymphaticnetwork.org/news-events/understanding-lower-extremity-phlebolymphedema-fibrosis
- Phlebolymphedema: an up-to-date review – Servier – Phlebolymphology, https://www.phlebolymphology.org/phlebolymphedema-an-up-to-date-review/
- ECOCOLORDOPPLER IN MEDICINA INTERNA – Dottor Massa, Ecografia Lecce – Mario Filippo Antonio Massa, Consulenze di medicina legale,Patologie infettive e su base immunitaria,Patologie dell’app. digerente,Patologie epatiche e delle vie biliari,Prevenzione oncologica e diagnosi precoce,Prevenzione infettivologica e diagnosi precoce,Prevenzione cardiovascolare e metabolica,Prevenzione malpractice,Collo – Dott. Mario Filippo Antonio Massa, https://www.dottormassa.it/patologia-carotidea-dei-tronchi-aortici/
- New diagnostic modalities in lymphedema – Servier – Phlebolymphology,https://www.phlebolymphology.org/new-diagnostic-modalities-in-lymphedema/
- (PDF) Significance of Ultrasound Examination of Skin and Subcutaneous Tissue in Secondary Lower Extremity Lymphedema – ResearchGate, https://www.researchgate.net/publication/245029817_Significance_of_Ultrasound_Examination_of_Skin_and_Subcutaneous_Tissue_in_Secondary_Lower_Extremity_Lymphedema
- Staging liver fibrosis with shear wave elastography – Radiology Key, https://radiologykey.com/staging-liver-fibrosis-with-shear-wave-elastography-2/
- Can Tissue Stiffness Measured Using Shear-Wave Elastography Represent Lymphedema in Breast Cancer? – PubMed, https://pubmed.ncbi.nlm.nih.gov/35394367/
- Skin Layer Thickness and Shear Wave Elastography Changes Induced by Intensive Decongestive Treatment of Lower Limb Lymphedema – NIH, https://pmc.ncbi.nlm.nih.gov/articles/PMC8892981/
- Standard of Care: Lymphedema Case Type / Diagnosis – Brigham and Women’s Hospital, https://www.brighamandwomens.org/assets/BWH/patients-and-families/rehabilitation-services/pdfs/general-lymphedema-bwh.pdf
- Measurement Guidelines – for Lymphedema – Klose Training, https://klosetraining.com/wp-content/uploads/2019/08/JOBST-Measurement-Guidelines.pdf
- Ultrasonographic features of the skin and subcutis: correlations with the severity of breast cancer–related lymphedema – NIH, https://pmc.ncbi.nlm.nih.gov/articles/PMC11222127/




